Metabolito de un comensal intestinal media la resistencia de colonización a infección por Salmonella
27 July, 2018
¿Salmonelosis? La culpa es de su flora intestinal. Por M. López. abc.es. 26/07/18. El propionato, metabolito liberado por los bacteroides de la flora intestinal, dificulta la división y crecimiento de la bacteria de la ‘Salmonella’.La salmonelosis es una enfermedad infecciosa producida por bacterias del género ‘Salmonella’ y que se contrae por la ingesta de alimentos contaminados, por lo general huevos, carnes y productos lácteos. Leer también: Salmonelosis, la intoxicación alimentaria más habitual del verano.Otras bacterias. Cómo prevenirlas

Microscopía electrónica de Salmonella typhimurium
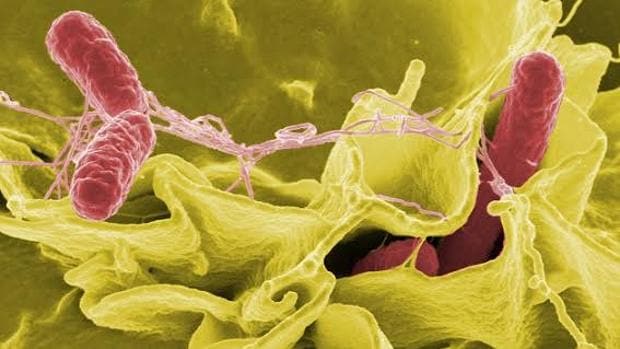 ‘Salmonella typhimurium’ – WIKIPEDIAUna enfermedad de la que anualmente se registran decenas de millones de casos en todo el mundo y que, si bien suele cursar con los síntomas característicos de la gastroenteritis –dolor abdominal, náuseas, vómitos, diarrea, escalofríos y fiebre–, puede llegar a resultar letal. De hecho, la Organización Mundial de la Salud (OMS) estima que la salmonelosis es responsable cada año de más de 100.000 defunciones en todo el planeta. Pero, ¿de qué depende que la infección sea asintomática, curse de forma leve o moderada o incluso pueda resultar mortal? Pues como muestra un estudio llevado a cabo por investigadores de la Facultad de Medicina de la Universidad de Stanford (EE.UU.), de la composición de la floral intestinal. Más concretamente, de la presencia de bacterias del género ‘Bacteroides’, responsables de la liberación de una molécula que, denominada ‘propionato’, interfiere con el crecimiento y expansión de la ‘Salmonella’. Y es incluso mejor que los antibióticos.
‘Salmonella typhimurium’ – WIKIPEDIAUna enfermedad de la que anualmente se registran decenas de millones de casos en todo el mundo y que, si bien suele cursar con los síntomas característicos de la gastroenteritis –dolor abdominal, náuseas, vómitos, diarrea, escalofríos y fiebre–, puede llegar a resultar letal. De hecho, la Organización Mundial de la Salud (OMS) estima que la salmonelosis es responsable cada año de más de 100.000 defunciones en todo el planeta. Pero, ¿de qué depende que la infección sea asintomática, curse de forma leve o moderada o incluso pueda resultar mortal? Pues como muestra un estudio llevado a cabo por investigadores de la Facultad de Medicina de la Universidad de Stanford (EE.UU.), de la composición de la floral intestinal. Más concretamente, de la presencia de bacterias del género ‘Bacteroides’, responsables de la liberación de una molécula que, denominada ‘propionato’, interfiere con el crecimiento y expansión de la ‘Salmonella’. Y es incluso mejor que los antibióticos.Como explica Amanda Jacobson, directora de esta investigación publicada en la revista «Cell Host & Microbe», «el microbioma intestinal es un ecosistema increíblemente complejo. Billones de bacterias, virus y hongos forman interacciones complejas entre sí y con el hospedador en un ambiente muy heterogéneo. En consecuencia, resulta muy difícil identificar qué moléculas liberadas por cada microorganismo son responsables de características específicas como las resistencias a las bacterias».
Acidificación bacterianaLos científicos llevan años utilizando diferentes cepas de ratones para tratar de identificar los genes implicados en la susceptibilidad a las infecciones por patógenos intestinales. Sin embargo, los autores del nuevo estudio optaron por fijarse en la flora intestinal de los ratones para ver si su variabilidad condicionaba, de una u otra manera, la respuesta a la infección. Y para ello, se centraron en dos cepas de ratones de laboratorio bien conocidas por sus divergencias en la respuesta a la infección por las bacterias del género ‘Salmonella’. Y es que mientras la infección cursa de forma asintomática en una de las cepas, en la otra llega a causar auténticos estragos. Una situación similar a la que se observa en muchas personas.
Como refiere Denise Monack, co-autora de la investigación, «la respuesta a la exposición a las infecciones bacterianas varía según la persona. Dependiendo del caso, algunas personas contraen la infección y otras no, algunas caen enfermas y otras permanecen sanas, y algunas expanden la infección mientras que otras la eliminan. Y que existan estas diferencias supone un auténtico misterio. De ahí la importancia de nuestros resultados, que pueden arrojar luz sobre este fenómeno».
Cuando las concentraciones de propionato son altas en el intestino, la ‘Salmonella’ no puede llevar a cabo las funciones celulares necesarias para su crecimientoEn primer lugar, los autores trataron a cada uno de los animales con antibióticos para eliminar las bacterias de sus microbiotas intestinales y, acto seguido, inocularon en sus intestinos las heces –el consabido y nauseabundo ‘trasplante fecal’– de algún otro ratón. Así, tan solo había que ver que animales trasplantados desarrollaban resistencia a la infección y analizar la composición de las bacterias presentes en las heces trasplantadas. ¿Y qué pasó? Pues que de acuerdo los con los resultados, la ‘flora resistente’ a la salmonelosis tenía concentraciones mucho mayores de especies bacterianas del género ‘Bacteroides’.
El siguiente paso fue analizar la razón por la que los microbiomas ricos en bacteroides eran resistentes a la infección. Durante el metabolismo, los bacteroides liberan ácidos grasos de cadena corta como acetato, buriato y propionato. Y los niveles de este último eran tres veces más elevados en las floras resistentes que en las que no lo eran. Tal es así que los autores evaluaron la posibilidad de que este propionato, tal y como hacen otros ácidos grasos de cadena corta, potenciara la actividad del sistema inmune, en este caso frente a las bacterias del género ‘Salmonella’. Con resultados absolutamente negativos.
Entonces, si el propionato confiere la resistencia a la salmonelosis pero no aumenta la actividad inmune, ¿cómo lo hace? Pues según los resultados, porque disminuye de forma muy significativa el pH intracelular –o lo que es lo mismo, aumenta la acidez– de la ‘Salmonella’, por lo que la bacteria tiene grandes dificultades para dividirse y crecer.
¿Mejor que los antibióticos?En definitiva, como apunta Amanda Jacobson, «nuestro estudio muestra que cuando las concentraciones de propionato, que es producido por los bacteroides, son altas en el intestino, la bacteria de la ‘Salmonella’ es incapaz de elevar su pH interno para facilitar las funciones celulares necesarias para su crecimiento. Lógicamente, queremos ver cómo trasladar este descubrimiento a los humanos. Y para ello, el próximo paso será determinar la biología básica del propionato y ver cómo funciona a nivel molecular».
Es más; el nuevo hallazgo también puede tener modificar el tratamiento actual de la salmonelosis, que en un gran número de ocasiones requiere la administración de antibióticos. Lo cual puede resultar un problema dado que estos fármacos también acaban con las bacterias ‘buenas’ de la flora que velan por la salud del intestino. Algo que no sucedería con el propionato.
Como concluye Denise Monack, «la reducción del uso de antibióticos es un beneficio adicional porque la sobreutilización de estos fármacos incrementan la incidencia de microorganismos resistentes».
Referencia bibliografíca: Jacobson, Amanda et al. A Gut Commensal-Produced Metabolite Mediates Colonization Resistance to Salmonella Infection. Cell Host & Microbe , Volume 0 , Issue 0 ,DOI: https://doi.org/10.1016/j.chom.2018.07.002
